PROM-Schnelltest
VERWENDUNGSZWECK
Der StrongStep®Der PROM-Test ist ein visuell interpretierter, qualitativer immunochromatographischer Test zum Nachweis von IGFBP-1 aus Fruchtwasser im Vaginalsekret während der Schwangerschaft.Der Test ist für den professionellen Gebrauch bestimmt, um bei der Diagnose des Blasensprungs (ROM) bei schwangeren Frauen zu helfen.
EINLEITUNG
Die Konzentration von IGFBP-1 (Insulin-like Growth Factor Binding Protein-1) im Fruchtwasser ist 100- bis 1000-mal höher als im mütterlichen Serum.IGFBP-1 ist normalerweise nicht in der Vagina vorhanden, aber nach einem Bruch der fötalen Membranen vermischt sich Fruchtwasser mit einer hohen Konzentration an IGFBP-1 mit Vaginalsekreten.Beim StrongStep® PROM-Test wird eine Probe des Vaginalsekrets mit einem sterilen Polyestertupfer entnommen und die Probe in die Probenextraktionslösung extrahiert.Das Vorhandensein von IGFBP-1 in der Lösung wird mit einem Schnelltestgerät nachgewiesen.
PRINZIP
Der StrongStep®Der PROM-Test verwendet die farbimmunchromatographische Kapillarflusstechnologie.Das Testverfahren erfordert die Solubilisierung von IGFBP-1 aus einem Vaginalabstrich durch Mischen des Abstrichs mit Probenpuffer.Dann wird der gemischte Probenpuffer in die Probenvertiefung der Testkassette gegeben und die Mischung wandert entlang der Membranoberfläche.Wenn IGFBP-1 in der Probe vorhanden ist, bildet es einen Komplex mit dem primären Anti-IGFBP-1-Antikörper, der an farbige Partikel konjugiert ist.Der Komplex wird dann von einem zweiten Anti-IGFBP-1-Antikörper gebunden, der auf die Nitrozellulosemembran aufgetragen wird.Das Erscheinen einer sichtbaren Testlinie zusammen mit der Kontrolllinie zeigt ein positives Ergebnis an.
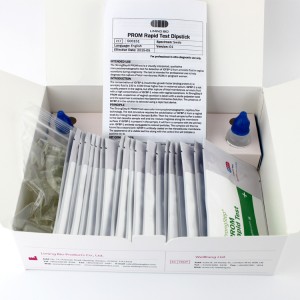
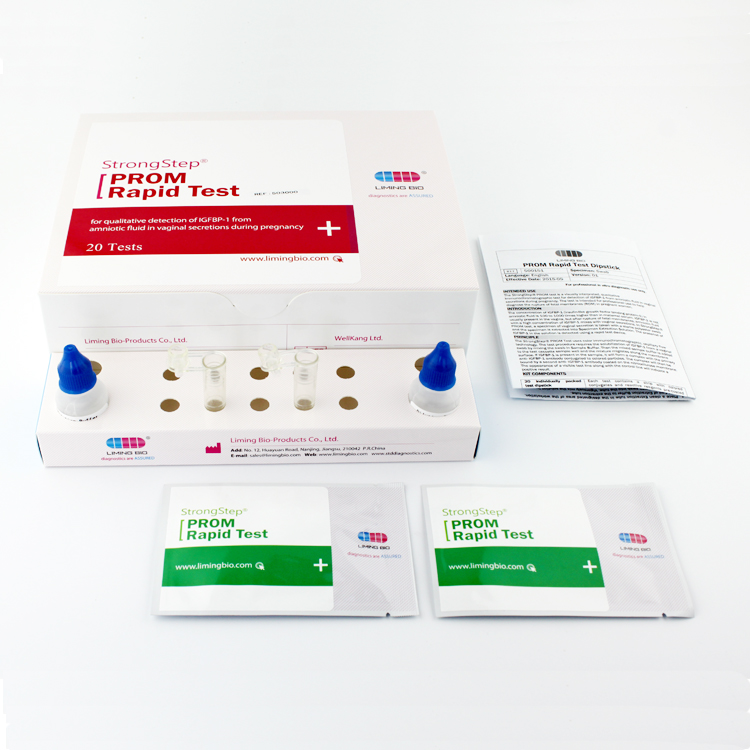
KIT-KOMPONENTEN
| 20 Individuell packed Testgeräte | Jede Einheit enthält einen Streifen mit farbigen Konjugaten und reaktiven Reagenzien, die an den entsprechenden Stellen vorbeschichtet sind. |
| 2ExtraktionPufferfläschchen | 0,1 M phosphatgepufferte Kochsalzlösung (PBS) und 0,02 % Natriumazid. |
| 1 positiver Kontrolltupfer (nur auf Anfrage) | Enthält IGFBP-1 und Natriumazid.Für externe Steuerung. |
| 1 negativer Kontrolltupfer (nur auf Anfrage) | IGFBP-1 nicht enthalten.Für externe Steuerung. |
| 20 Extraktionsrohre | Zur Probenvorbereitung verwenden. |
| 1 Arbeitsplatz | Platz zum Halten von Pufferfläschchen und Röhrchen. |
| 1 Packungsbeilage | Zur Bedienungsanleitung. |
BENÖTIGTE MATERIALIEN, DIE NICHT MITGELIEFERT WERDEN
| Timer | Für die Zeitmessung. |
VORSICHTSMASSNAHMEN
■ Nur für den professionellen Gebrauch in der In-vitro-Diagnostik.
■ Nicht nach dem auf der Verpackung angegebenen Verfallsdatum verwenden.Verwenden Sie den Test nicht, wenn sein Folienbeutel beschädigt ist.Tests nicht wiederverwenden.
■ Dieses Kit enthält Produkte tierischen Ursprungs.Zertifizierte Kenntnis der Herkunft und/oder des Gesundheitszustandes der Tiere garantiert nicht die vollständige Abwesenheit von übertragbaren Krankheitserregern.Es wird daher empfohlen, diese Produkte als potenziell infektiös zu behandeln und unter Einhaltung der üblichen Sicherheitsvorkehrungen zu handhaben (nicht einnehmen oder einatmen).
■ Vermeiden Sie eine Kreuzkontamination von Proben, indem Sie für jede entnommene Probe einen neuen Probensammelbehälter verwenden.
■ Lesen Sie das gesamte Verfahren sorgfältig durch, bevor Sie Tests durchführen.
■ In dem Bereich, in dem die Proben und Kits gehandhabt werden, nicht essen, trinken oder rauchen.Behandeln Sie alle Proben so, als ob sie Infektionserreger enthalten würden.Beachten Sie während des gesamten Verfahrens die etablierten Vorsichtsmaßnahmen gegen mikrobiologische Gefahren und befolgen Sie die Standardverfahren für die ordnungsgemäße Entsorgung von Proben.Tragen Sie bei der Untersuchung von Proben Schutzkleidung wie Laborkittel, Einweghandschuhe und Augenschutz.
■ Vertauschen oder mischen Sie keine Reagenzien aus verschiedenen Chargen.Mischen Sie die Kappen der Lösungsflaschen nicht.
■ Feuchtigkeit und Temperatur können die Ergebnisse beeinträchtigen.
■ Entsorgen Sie die Tupfer nach Abschluss des Testverfahrens sorgfältig, nachdem Sie sie mindestens 20 Minuten lang bei 121 °C autoklaviert haben.Alternativ können sie vor der Entsorgung eine Stunde lang mit 0,5 % Natriumhypochlorid (oder Haushaltsbleiche) behandelt werden.Die verwendeten Testmaterialien sind gemäß den örtlichen, staatlichen und/oder bundesstaatlichen Vorschriften zu entsorgen.
■ Zytologiebürsten nicht bei schwangeren Patientinnen verwenden.
LAGERUNG UND STABILITÄT
■ Das Kit sollte bei 2-30 °C bis zum auf dem versiegelten Beutel aufgedruckten Verfallsdatum gelagert werden.
■ Der Test muss bis zur Verwendung im versiegelten Beutel bleiben.
■ Nicht einfrieren.
■ Die Komponenten in diesem Kit sind sorgfältig vor Kontamination zu schützen.Nicht verwenden, wenn Anzeichen einer mikrobiellen Kontamination oder Ausfällung vorliegen.Biologische Kontamination von Dosiergeräten, Behältern oder Reagenzien kann zu falschen Ergebnissen führen.
PROBENENTNAHME UND -AUFBEWAHRUNG
Verwenden Sie nur sterile Tupfer mit Dacron- oder Rayon-Spitze und Kunststoffschäften.Es wird empfohlen, die vom Kit-Hersteller gelieferten Tupfer zu verwenden (Die Tupfer sind nicht in diesem Kit enthalten, für Bestellinformationen wenden Sie sich bitte an den Hersteller oder lokalen Händler, die Katalognummer ist 207000).Abstrichtupfer anderer Anbieter wurden nicht validiert.Tupfer mit Baumwollspitzen oder Holzschäften werden nicht empfohlen.
■ Eine Probe wird mit einem sterilen Polyestertupfer entnommen.Die Probe sollte vor der Durchführung einer digitalen Untersuchung und/oder eines transvaginalen Ultraschalls entnommen werden.Achten Sie darauf, nichts mit dem Tupfer zu berühren, bevor Sie die Probe entnehmen.Führen Sie die Spitze des Tupfers vorsichtig in Richtung des hinteren Fornix in die Vagina ein, bis Sie auf Widerstand stoßen.Alternativ kann die Probe im Rahmen einer sterilen Spekulumuntersuchung aus dem hinteren Fornix entnommen werden.Der Tupfer sollte 10-15 Sekunden in der Vagina belassen werden, damit er das Vaginalsekret aufnehmen kann.Ziehen Sie den Tupfer vorsichtig heraus!.
■ Legen Sie den Tupfer auf das Extraktionsröhrchen, wenn der Test sofort durchgeführt werden kann.Wenn eine sofortige Testung nicht möglich ist, sollten die Patientenproben zur Lagerung oder zum Transport in ein trockenes Transportröhrchen gegeben werden.Die Tupfer können 24 Stunden bei Raumtemperatur (15-30 °C) oder 1 Woche bei 4 °C oder nicht länger als 6 Monate bei -20 °C aufbewahrt werden.Alle Proben sollten vor dem Testen auf eine Raumtemperatur von 15-30°C gebracht werden.
VERFAHREN
Tests, Proben, Puffer und/oder Kontrollen vor Gebrauch auf Raumtemperatur (15-30°C) bringen.
■ Legen Sie ein sauberes Extraktionsröhrchen in den dafür vorgesehenen Bereich der Arbeitsstation.Geben Sie 1 ml Extraktionspuffer in das Extraktionsröhrchen.
■ Geben Sie den Probentupfer in das Röhrchen.Mischen Sie die Lösung kräftig, indem Sie den Tupfer mindestens zehnmal kräftig gegen die Seite des Röhrchens drehen (während er eingetaucht ist).Die besten Ergebnisse werden erzielt, wenn die Probe kräftig in die Lösung gemischt wird.
■ Drücken Sie so viel Flüssigkeit wie möglich aus dem Tupfer, indem Sie beim Entfernen des Tupfers auf die Seite des flexiblen Entnahmeschlauchs drücken.Mindestens die Hälfte der Probenpufferlösung muss im Röhrchen verbleiben, damit eine ausreichende Kapillarwanderung stattfinden kann.Setzen Sie die Kappe auf das herausgezogene Röhrchen.
Entsorgen Sie den Tupfer in einem geeigneten Behälter für biologisch gefährlichen Abfall.
■ Die entnommenen Proben können 60 Minuten lang bei Raumtemperatur aufbewahrt werden, ohne das Testergebnis zu beeinflussen.
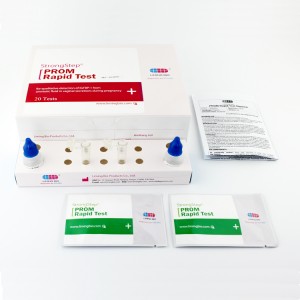
■ Nehmen Sie den Test aus dem versiegelten Beutel und legen Sie ihn auf eine saubere, ebene Oberfläche.Beschriften Sie das Gerät mit der Patienten- oder Kontrollidentifikation.Um ein optimales Ergebnis zu erzielen, sollte der Assay innerhalb einer Stunde durchgeführt werden.
■ Geben Sie 3 Tropfen (ca. 100 µl) der extrahierten Probe aus dem Extraktionsröhrchen in die Probenvertiefung der Testkassette.
Vermeiden Sie das Einschließen von Luftblasen in der Probenvertiefung (S) und tropfen Sie keine Lösung in das Beobachtungsfenster.
Wenn der Test zu arbeiten beginnt, sehen Sie, wie sich die Farbe über die Membran bewegt.
■ Warten Sie, bis die farbigen Bänder erscheinen.Das Ergebnis sollte nach 5 Minuten abgelesen werden.Interpretieren Sie das Ergebnis nicht nach 5 Minuten.
Entsorgen Sie gebrauchte Reagenzgläser und Testkassetten in einem geeigneten Behälter für biologisch gefährlichen Abfall.
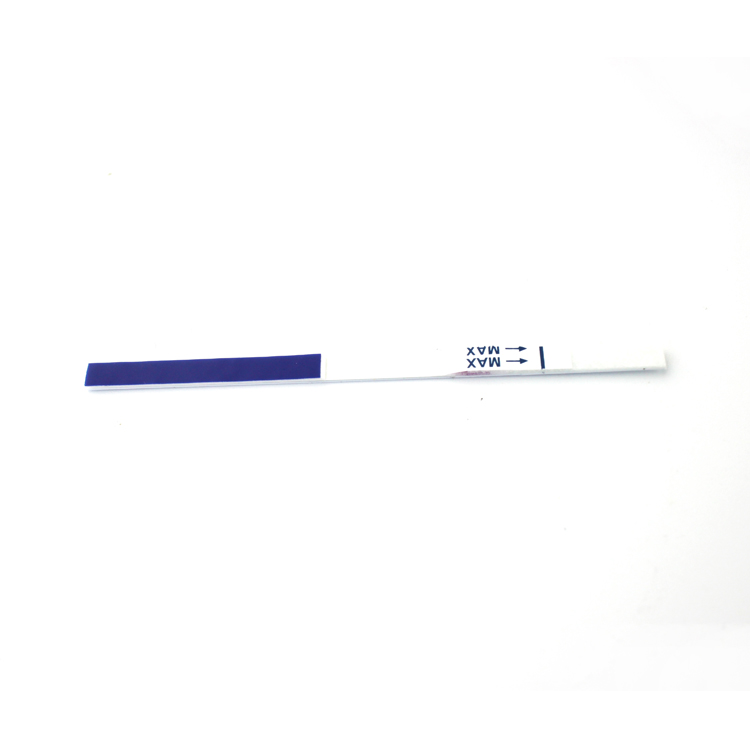
INTERPRETATION DER ERGEBNISSE
| POSITIVERGEBNIS:
| Auf der Membran erscheinen zwei farbige Bänder.Eine Bande erscheint in der Kontrollregion (C) und eine andere Bande erscheint in der Testregion (T). |
| NEGATIVERGEBNIS:
| Im Kontrollbereich (C) erscheint nur eine farbige Bande.In der Testregion (T) erscheint kein sichtbares farbiges Band. |
| UNGÜLTIGERGEBNIS:
| Das Kontrollband wird nicht angezeigt.Ergebnisse von Tests, die zur angegebenen Ablesezeit keine Kontrollbande ergeben haben, müssen verworfen werden.Bitte überprüfen Sie das Verfahren und wiederholen Sie es mit einem neuen Test.Wenn das Problem weiterhin besteht, stellen Sie die Verwendung des Kits sofort ein und wenden Sie sich an Ihren Händler vor Ort. |
HINWEIS:
1. Die Farbintensität im Testbereich (T) kann je nach Konzentration der Zielsubstanzen in der Probe variieren.Aber der Stoffgehalt kann durch diesen qualitativen Test nicht bestimmt werden.
2. Unzureichendes Probenvolumen, falsche Bedienung oder abgelaufene Tests sind die wahrscheinlichsten Gründe für das Versagen der Kontrollbande.
QUALITÄTSKONTROLLE
■ Interne Verfahrenskontrollen sind im Test enthalten.Eine im Kontrollbereich (C) erscheinende farbige Bande gilt als interne positive Verfahrenskontrolle.Es bestätigt ein ausreichendes Probenvolumen und eine korrekte Verfahrenstechnik.
■ Externe Verfahrenskontrollen können (nur auf Anfrage) in den Kits enthalten sein, um sicherzustellen, dass die Tests ordnungsgemäß funktionieren.Die Kontrollen können auch verwendet werden, um die ordnungsgemäße Leistung durch den Prüfer zu demonstrieren.Führen Sie zur Durchführung eines positiven oder negativen Kontrolltests die Schritte im Abschnitt „Testverfahren“ durch und behandeln Sie den Kontrolltupfer auf die gleiche Weise wie einen Probentupfer.
EINSCHRÄNKUNGEN DES TESTS
1. Basierend auf den Testergebnissen sollte keine quantitative Interpretation vorgenommen werden.
2. Verwenden Sie den Test nicht, wenn sein Aluminiumfolienbeutel oder die Versiegelung des Beutels nicht intakt sind.
3. Ein positiver StrongStep®Das Ergebnis des PROM-Tests weist zwar das Vorhandensein von Fruchtwasser in der Probe nach, lokalisiert jedoch nicht die Rupturstelle.
4.Wie bei allen diagnostischen Tests müssen die Ergebnisse im Lichte anderer klinischer Befunde interpretiert werden.
5.Wenn ein Blasensprung aufgetreten ist, aber das Austreten von Fruchtwasser mehr als 12 Stunden vor der Probenentnahme aufgehört hat, wurde IGFBP-1 möglicherweise durch Proteasen in der Vagina abgebaut und der Test kann ein negatives Ergebnis ergeben.
LEISTUNGSMERKMALE
Tabelle: StrongStep®PROM-Test vs. PROM-Test einer anderen Marke
|
Relative Empfindlichkeit: |
| Eine andere Marke |
| ||
| + | - | Gesamt | |||
| Starker Schritt®ABSCHLUSSBALL Prüfen | + | 63 | 3 | 66 | |
| - | 2 | 138 | 140 | ||
|
| 65 | 141 | 206 | ||
Analytische Sensibilität
Die niedrigste nachweisbare Menge an IGFBP-1 in der extrahierten Probe beträgt 12,5 μg/l.
Störende Substanzen
Es muss darauf geachtet werden, dass der Applikator oder Zervikovaginalsekrete nicht mit Gleitmitteln, Seifen, Desinfektionsmitteln oder Cremes kontaminiert werden.Gleitmittel oder Cremes können die Absorption der Probe auf dem Applikator physikalisch beeinträchtigen.Seifen oder Desinfektionsmittel können die Antikörper-Antigen-Reaktion stören.
Potenziell störende Substanzen wurden in Konzentrationen getestet, die vernünftigerweise in Zervikovaginalsekreten gefunden werden könnten.Die folgenden Substanzen störten den Assay nicht, wenn sie in den angegebenen Konzentrationen getestet wurden.
| Substanz | Konzentration | Substanz | Konzentration |
| Ampicillin | 1,47 mg/ml | Prostaglandin F2 | 0,033 mg/ml |
| Erythromycin | 0,272 mg/ml | Prostaglandin E2 | 0,033 mg/ml |
| Mütterlicher Urin 3. Trimester | 5 % (Vol.) | MonistatR (Miconazol) | 0,5 mg/ml |
| Oxytocin | 10 IE/ml | Indigo Karmin | 0,232 mg/ml |
| Terbutalin | 3,59 mg/ml | Gentamicin | 0,849 mg/ml |
| Dexamethason | 2,50 mg/ml | Betadine® Gel | 10 mg/ml |
| MgSO4•7H2O | 1,49 mg/ml | BetadineR Reiniger | 10 mg/ml |
| Ritodrin | 0,33 mg/ml | K-YR-Gelee | 62,5 mg/ml |
| Dermicidol® 2000 | 25,73 mg/ml |
LITERATUR REFERENZEN
Erdemoglu und Mungan T. Bedeutung des Nachweises von insulinähnlichem Wachstumsfaktor-bindendem Protein-1 in Zervikovaginalsekreten: Vergleich mit Nitrazintest und Beurteilung des Fruchtwasservolumens.Acta Obstet Gynecol Scand (2004) 83:622-626.
Kubota T und Takeuchi H. Bewertung des insulinähnlichen Wachstumsfaktor-Bindungsproteins 1 als diagnostisches Werkzeug für den Bruch der Membranen.J Obstet Gynecol Res (1998) 24: 411–417.
Rutanen EM et al.Evaluation eines Schnellteststreifens für insulinähnliches Wachstumsfaktor-bindendes Protein-1 in der Diagnose von rupturierten fetalen Membranen.ClinChimActa (1996) 253:91–101.
Rutanen EM, Pekonen F, Karkkainen T. Messung des insulinähnlichen Wachstumsfaktor-Bindungsproteins 1 in Zervix-/Vaginalsekreten: Vergleich mit dem ROM-Check-Membran-Immunoassay bei der Diagnose rupturierter fetaler Membranen.Clin ChimActa (1993) 214: 73–81.
GLOSSAR DER SYMBOLE
|
| Katalognummer |  | Temperaturbegrenzung |
 | Gebrauchsanweisung konsultieren |
| Batch-Code |
 | In-vitro-Diagnostikum |  | Verwenden von |
 | Hersteller |  | Enthält ausreichend fürPrüfungen |
 | Nicht wiederverwenden |  | Bevollmächtigter Vertreter in der Europäischen Gemeinschaft |
 | CE-gekennzeichnet gemäß IVD-Medizinprodukte-Richtlinie 98/79/EG | ||