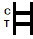Fetaler Fibronektin-Schnelltest
VORGESEHENER GEBRAUCH
Der StrongStep®Der PROM-Test ist ein visuell interpretierter immunochromatographischer Test, der für den qualitativen Nachweis von fötalem Fibronektin in Zervikovaginalsekreten bestimmt ist.Das Vorhandensein von fötalem Fibronektin in Zervikovaginalsekreten zwischen 22 Wochen, 0 Tage und 34 Wochen, 6 Tage der Schwangerschaft istverbunden mit erhöhtem Frühgeburtsrisiko.
EINFÜHRUNG
Frühgeburten, definiert vom American College of Obstetricians and Gynecologists als Geburten vor der 37. Schwangerschaftswoche, sind für den Großteil der nicht-chromosomalen perinatalen Morbidität und Mortalität verantwortlich.Zu den Symptomen einer drohenden Frühgeburt gehören Uteruskontraktionen, Veränderung des Scheidenausflusses, Blutungen aus der Scheide, Rückenschmerzen, Bauchbeschwerden, Beckendruck und Krämpfe.Zu den diagnostischen Modalitäten zur Erkennung einer drohenden Frühgeburt gehören die Überwachung der Uterusaktivität und die Durchführung einer digitalen Zervixuntersuchung, die eine Abschätzung der zervikalen Dimensionen ermöglicht.Diese Methoden haben sich als begrenzt erwiesen, da eine minimale Zervixdilatation (< 3 Zentimeter) und Uterusaktivität normal auftreten und nicht unbedingt auf eine bevorstehende Frühgeburt hindeuten.Während mehrere biochemische Serummarker evaluiert wurden, wurde keiner für die praktische klinische Verwendung allgemein akzeptiert.
Fötales Fibronektin (fFN), eine Isoform von Fibronektin, ist ein komplexes adhäsives Glykoprotein mit einem Molekulargewicht von etwa 500.000 Dalton.Matsuura und Mitarbeiter haben einen monoklonalen Antikörper namens FDC-6 beschrieben, der spezifisch III-CS erkennt, die Region, die die fötale Isoform von Fibronektin definiert.Immunhistochemische Studien von Plazenten haben gezeigt, dass fFN istauf die extrazelluläre Matrix der Region beschränkt, die die Verbindung definiertder mütterlichen und fötalen Einheiten innerhalb der Gebärmutter.
Fötales Fibronectin kann während der gesamten Schwangerschaft in Zervikovaginalsekreten von Frauen durch Verwendung eines auf monoklonalen Antikörpern basierenden Immunassays nachgewiesen werden.Fötales Fibronectin ist in zervikovaginalen Sekreten während der Frühschwangerschaft erhöht, aber in normalen Schwangerschaften von der 22. auf die 35. Woche verringert.Die Bedeutung seiner Anwesenheit in der Vagina während der ersten Schwangerschaftswochen ist nicht bekannt.Es kann jedoch einfach das normale Wachstum der extravillösen Trophoblastenpopulation und der Plazenta widerspiegeln.Der Nachweis von fFN in Zervikovaginalsekreten zwischen der 22. SSW, 0 Tage und 34. SSW, 6. SSW wird bei symptomatischen und zwischen der 22. SSW, 0. SSW und 30. SSW, 6 Tagen bei asymptomatischen Schwangeren mit einer Frühgeburt assoziiert.
PRINZIP
Der StrongStep®Der fFN-Test verwendet die farbimmunchromatographische Kapillarflusstechnologie.Das Testverfahren erfordert die Solubilisierung von fFN aus einem Vaginalabstrich durch Mischen des Abstrichs mit Probenpuffer.Dann wird der gemischte Probenpuffer in die Probenvertiefung der Testkassette gegeben und die Mischung wandert entlang der Membranoberfläche.Wenn fFN in der Probe vorhanden ist, bildet es einen Komplex mit dem primären Anti-fFN-Antikörper, der an farbige Partikel konjugiert ist.Der Komplex wird dann von einem zweiten Anti-fFN-Antikörper gebunden, der auf die Nitrozellulosemembran aufgetragen wird.Das Erscheinen einer sichtbaren Testlinie zusammen mit der Kontrolllinie zeigt ein positives Ergebnis an.
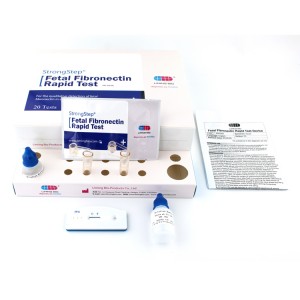
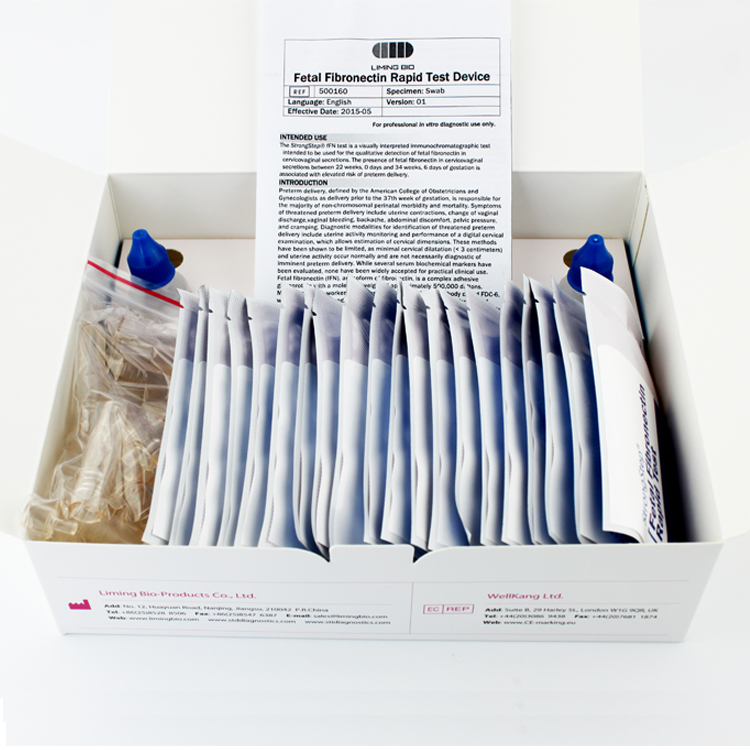
KIT-KOMPONENTEN
| 20 Individuell packed Testgeräte | Jede Einheit enthält einen Streifen mit farbigen Konjugaten und reaktiven Reagenzien, die an den entsprechenden Stellen vorbeschichtet sind. |
| 2ExtraktionPufferfläschchen | 0,1 M phosphatgepufferte Kochsalzlösung (PBS) und 0,02 % Natriumazid. |
| 1 positiver Kontrolltupfer (nur auf Anfrage) | Enthält fFN und Natriumazid.Für externe Steuerung. |
| 1 negativer Kontrolltupfer (nur auf Anfrage) | Enthält kein fFN.Für externe Steuerung. |
| 20 Extraktionsrohre | Zur Probenvorbereitung verwenden. |
| 1 Arbeitsplatz | Platz zum Halten von Pufferfläschchen und Röhrchen. |
| 1 Packungsbeilage | Zur Bedienungsanleitung. |
BENÖTIGTE MATERIALIEN, DIE NICHT MITGELIEFERT WERDEN
| Timer | Für die Zeitmessung. |
VORSICHTSMASSNAHMEN
■ Nur für den professionellen Gebrauch in der In-vitro-Diagnostik.
■ Nicht nach dem auf der Verpackung angegebenen Verfallsdatum verwenden.Verwenden Sie den Test nicht, wenn sein Folienbeutel beschädigt ist.Tests nicht wiederverwenden.
■ Dieses Kit enthält Produkte tierischen Ursprungs.Zertifizierte Kenntnis der Herkunft und/oder des Gesundheitszustandes der Tiere garantiert nicht die vollständige Abwesenheit von übertragbaren Krankheitserregern.Es wird daher empfohlen, diese Produkte als potenziell infektiös zu behandeln und unter Einhaltung der üblichen Sicherheitsvorkehrungen zu handhaben (nicht einnehmen oder einatmen).
■ Vermeiden Sie eine Kreuzkontamination von Proben, indem Sie für jede entnommene Probe einen neuen Probensammelbehälter verwenden.
■ Lesen Sie das gesamte Verfahren sorgfältig durch, bevor Sie Tests durchführen.
■ In dem Bereich, in dem die Proben und Kits gehandhabt werden, nicht essen, trinken oder rauchen.Behandeln Sie alle Proben so, als ob sie Infektionserreger enthalten würden.Beachten Sie während des gesamten Verfahrens die etablierten Vorsichtsmaßnahmen gegen mikrobiologische Gefahren und befolgen Sie die Standardverfahren für die ordnungsgemäße Entsorgung von Proben.Tragen Sie bei der Untersuchung von Proben Schutzkleidung wie Laborkittel, Einweghandschuhe und Augenschutz.
■ Vertauschen oder mischen Sie keine Reagenzien aus verschiedenen Chargen.Mischen Sie die Kappen der Lösungsflaschen nicht.
■ Feuchtigkeit und Temperatur können die Ergebnisse beeinträchtigen.
■ Entsorgen Sie die Tupfer nach Abschluss des Testverfahrens sorgfältig, nachdem Sie sie mindestens 20 Minuten lang bei 121 °C autoklaviert haben.Alternativ können sie vor der Entsorgung eine Stunde lang mit 0,5 % Natriumhypochlorid (oder Haushaltsbleiche) behandelt werden.Die verwendeten Testmaterialien sind gemäß den örtlichen, staatlichen und/oder bundesstaatlichen Vorschriften zu entsorgen.
■ Zytologiebürsten nicht bei schwangeren Patientinnen verwenden.
LAGERUNG UND STABILITÄT
■ Das Kit sollte bei 2-30 °C bis zum auf dem versiegelten Beutel aufgedruckten Verfallsdatum gelagert werden.
■ Der Test muss bis zur Verwendung im versiegelten Beutel bleiben.
■ Nicht einfrieren.
■ Die Komponenten in diesem Kit sind sorgfältig vor Kontamination zu schützen.Nicht verwenden, wenn Anzeichen einer mikrobiellen Kontamination oder Ausfällung vorliegen.Biologische Kontamination von Dosiergeräten, Behältern oder Reagenzien kann zu falschen Ergebnissen führen.
SAMMLUNG UND LAGERUNG VON MUSTERN
■ Verwenden Sie nur sterile Tupfer mit Dacron- oder Rayon-Spitze und Kunststoffschäften.Es wird empfohlen, die vom Kit-Hersteller gelieferten Tupfer zu verwenden (Die Tupfer sind nicht in diesem Kit enthalten, für Bestellinformationen wenden Sie sich bitte an den Hersteller oder lokalen Händler, die Katalognummer ist 207000).Abstrichtupfer anderer Anbieter wurden nicht validiert.Tupfer mit Baumwollspitzen oder Holzschäften werden nicht empfohlen.
■ Zervikovaginale Sekrete werden aus dem hinteren Scheidengewölbe gewonnen.Der Sammelprozess soll schonend sein.Eine energische oder gewaltsame Entnahme, wie sie für mikrobiologische Kulturen üblich ist, ist nicht erforderlich.Drehen Sie während einer Untersuchung mit einem Spekulum vor jeder Untersuchung oder Manipulation des Gebärmutterhalses oder des Vaginaltrakts die Applikatorspitze etwa 10 Sekunden lang leicht über das hintere Scheidengewölbe, um Zervikovaginalsekrete zu absorbieren.Nachfolgende Versuche, die Applikatorspitze zu sättigen, können den Test ungültig machen.Entfernen Sie den Applikator und führen Sie den Test wie unten beschrieben durch.
■ Legen Sie den Tupfer auf das Extraktionsröhrchen, wenn der Test sofort durchgeführt werden kann.Wenn eine sofortige Testung nicht möglich ist, sollten die Patientenproben zur Lagerung oder zum Transport in ein trockenes Transportröhrchen gegeben werden.Die Tupfer können 24 Stunden bei Raumtemperatur (15-30 °C) oder 1 Woche bei 4 °C oder nicht länger als 6 Monate bei -20 °C aufbewahrt werden.Alle Proben sollten vor dem Testen auf eine Raumtemperatur von 15-30°C gebracht werden.
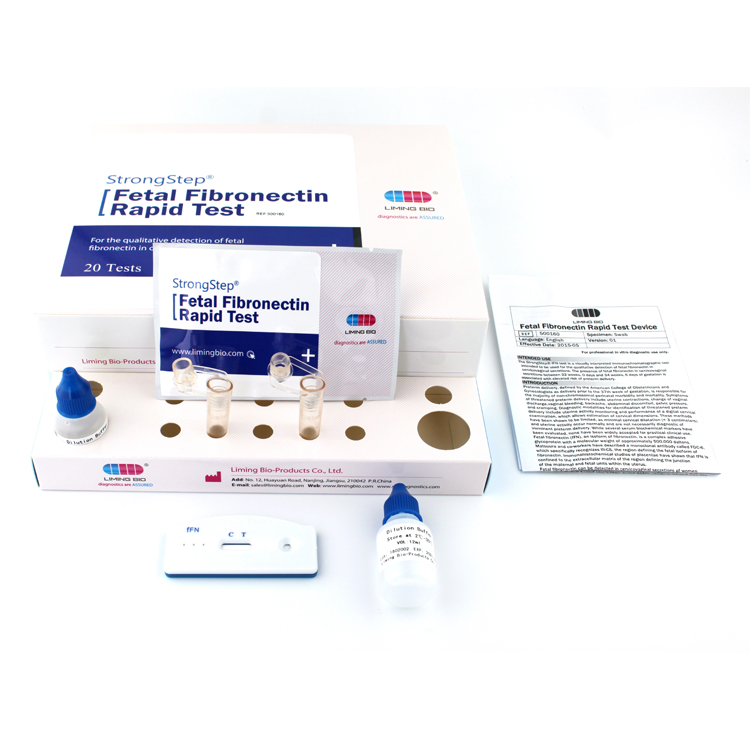
VERFAHREN
Tests, Proben, Puffer und/oder Kontrollen vor Gebrauch auf Raumtemperatur (15-30°C) bringen.
■ Legen Sie ein sauberes Extraktionsröhrchen in den dafür vorgesehenen Bereich der Arbeitsstation.Geben Sie 1 ml Extraktionspuffer in das Extraktionsröhrchen.
■ Geben Sie den Probentupfer in das Röhrchen.Mischen Sie die Lösung kräftig, indem Sie den Tupfer mindestens zehnmal kräftig gegen die Seite des Röhrchens drehen (während er eingetaucht ist).Die besten Ergebnisse werden erzielt, wenn die Probe kräftig in die Lösung gemischt wird.
■ Drücken Sie so viel Flüssigkeit wie möglich aus dem Tupfer, indem Sie beim Entfernen des Tupfers auf die Seite des flexiblen Entnahmeschlauchs drücken.Mindestens die Hälfte der Probenpufferlösung muss im Röhrchen verbleiben, damit eine ausreichende Kapillarwanderung stattfinden kann.Setzen Sie die Kappe auf das herausgezogene Röhrchen.
Entsorgen Sie den Tupfer in einem geeigneten Behälter für biologisch gefährlichen Abfall.
■ Die entnommenen Proben können 60 Minuten lang bei Raumtemperatur aufbewahrt werden, ohne das Testergebnis zu beeinflussen.
■ Nehmen Sie den Test aus dem versiegelten Beutel und legen Sie ihn auf eine saubere, ebene Oberfläche.Beschriften Sie das Gerät mit der Patienten- oder Kontrollidentifikation.Um ein optimales Ergebnis zu erzielen, sollte der Assay innerhalb einer Stunde durchgeführt werden.
■ Geben Sie 3 Tropfen (ca. 100 µl) der extrahierten Probe aus dem Extraktionsröhrchen in die Probenvertiefung der Testkassette.
Vermeiden Sie das Einschließen von Luftblasen in der Probenvertiefung (S) und tropfen Sie keine Lösung in das Beobachtungsfenster.
Wenn der Test zu arbeiten beginnt, sehen Sie, wie sich die Farbe über die Membran bewegt.
■ Warten Sie, bis die farbigen Bänder erscheinen.Das Ergebnis sollte nach 5 Minuten abgelesen werden.Interpretieren Sie das Ergebnis nicht nach 5 Minuten.
Entsorgen Sie gebrauchte Reagenzgläser und Testkassetten in einem geeigneten Behälter für biologisch gefährlichen Abfall.
INTERPRETATION DER ERGEBNISSE
| POSITIVERGEBNIS:
| Auf der Membran erscheinen zwei farbige Bänder.Eine Bande erscheint in der Kontrollregion (C) und eine andere Bande erscheint in der Testregion (T). |
| NEGATIVERGEBNIS:
| Im Kontrollbereich (C) erscheint nur eine farbige Bande.In der Testregion (T) erscheint kein sichtbares farbiges Band. |
| UNGÜLTIGERGEBNIS:
| Das Kontrollband wird nicht angezeigt.Ergebnisse von Tests, die zur angegebenen Ablesezeit keine Kontrollbande ergeben haben, müssen verworfen werden.Bitte überprüfen Sie das Verfahren und wiederholen Sie es mit einem neuen Test.Wenn das Problem weiterhin besteht, stellen Sie die Verwendung des Kits sofort ein und wenden Sie sich an Ihren Händler vor Ort. |
HINWEIS:
1. Die Farbintensität im Testbereich (T) kann je nach Konzentration der Zielsubstanzen in der Probe variieren.Aber der Stoffgehalt kann durch diesen qualitativen Test nicht bestimmt werden.
2. Unzureichendes Probenvolumen, falsche Bedienung oder abgelaufene Tests sind die wahrscheinlichsten Gründe für das Versagen der Kontrollbande.
QUALITÄTSKONTROLLE
■ Interne Verfahrenskontrollen sind im Test enthalten.Eine im Kontrollbereich (C) erscheinende farbige Bande gilt als interne positive Verfahrenskontrolle.Es bestätigt ein ausreichendes Probenvolumen und eine korrekte Verfahrenstechnik.
■ Externe Verfahrenskontrollen können (nur auf Anfrage) in den Kits enthalten sein, um sicherzustellen, dass die Tests ordnungsgemäß funktionieren.Die Kontrollen können auch verwendet werden, um die ordnungsgemäße Leistung durch den Prüfer zu demonstrieren.Führen Sie zur Durchführung eines positiven oder negativen Kontrolltests die Schritte im Abschnitt „Testverfahren“ durch und behandeln Sie den Kontrolltupfer auf die gleiche Weise wie einen Probentupfer.
EINSCHRÄNKUNGEN DES TESTS
1. Dieser Assay kann nur zum qualitativen Nachweis von fötalem Fibronektin in Zervikovaginalsekreten verwendet werden.
2. Testergebnisse sollten immer in Verbindung mit anderen klinischen und Labordaten für das Patientenmanagement verwendet werden.
3. Proben sollten vor der digitalen Untersuchung oder Manipulation des Gebärmutterhalses entnommen werden.Manipulationen am Gebärmutterhals können zu falsch positiven Ergebnissen führen.
4. Proben sollten nicht entnommen werden, wenn der Patient innerhalb von 24 Stunden Geschlechtsverkehr hatte, um falsch positive Ergebnisse auszuschließen.
5. Patientinnen mit Verdacht auf oder bekannter Plazentalösung, Plazenta praevia oder mäßiger oder starker Vaginalblutung sollten nicht getestet werden.
6. Patienten mit Cerclage sollten nicht getestet werden.
7. Die Leistungsmerkmale des StrongStep®Der fFN-Test basiert auf Studien an Frauen mit Einlingsschwangerschaften.Die Leistung wurde bei Patientinnen mit Mehrlingsschwangerschaften, z. B. Zwillingen, nicht verifiziert.
8. Der StrongStep®Der fFN-Test ist nicht zur Durchführung bei Vorhandensein von Fruchtwasserrissen vorgesehen, und ein Fruchtwasserriss sollte vor der Durchführung des Tests ausgeschlossen werden.
LEISTUNGSMERKMALE
Tabelle: StrongStep® fFN-Test vs. fFN-Test einer anderen Marke
| Relative Empfindlichkeit: 97,96 % (89,13 %-99,95 %)* Relative Spezifität: 98,73 % (95,50 %-99,85 %)* Allgemeine Vereinbarung: 98,55 % (95,82 %-99,70 %)* *95 % Konfidenzintervall |
| Eine andere Marke |
| ||
| + | - | Gesamt | |||
| Starker Schritt®fFn Prüfen | + | 48 | 2 | 50 | |
| - | 1 | 156 | 157 | ||
|
| 49 | 158 | 207 | ||
Analytische Sensibilität
Die niedrigste nachweisbare Menge an fFN in der extrahierten Probe beträgt 50 μg/l.
Bei symptomatischen Frauen weisen erhöhte fFN-Spiegel (≥ 0,050 μg/ml) (1 x 10-7 mmol/l) zwischen 24 Wochen, 0 Tagen und 34 Wochen, 6 Tagen auf ein erhöhtes Geburtsrisiko in ≤ 7 oder ≤ 14 Tagen hin Beispielsammlung.Bei asymptomatischen Frauen weisen erhöhte fFN-Spiegel zwischen 22 Wochen, 0 Tage und 30 Wochen, 6 Tage auf ein erhöhtes Geburtsrisiko in ≤ 34 Wochen, 6 Tage der Schwangerschaft hin.Der Grenzwert von 50 μg/L fFN wurde in einer multizentrischen Studie festgelegt, die durchgeführt wurde, um den Zusammenhang zwischen der fetalen Fibronectin-Expression während der Schwangerschaft und der Frühgeburt zu bewerten.
Störende Substanzen
Es muss darauf geachtet werden, dass der Applikator oder Zervikovaginalsekrete nicht mit Gleitmitteln, Seifen, Desinfektionsmitteln oder Cremes kontaminiert werden.Gleitmittel oder Cremes können die Absorption der Probe auf dem Applikator physikalisch beeinträchtigen.Seifen oder Desinfektionsmittel können die Antikörper-Antigen-Reaktion stören.
Potenziell störende Substanzen wurden in Konzentrationen getestet, die vernünftigerweise in Zervikovaginalsekreten gefunden werden könnten.Die folgenden Substanzen störten den Assay nicht, wenn sie in den angegebenen Konzentrationen getestet wurden.
| Substanz | Konzentration | Substanz | Konzentration |
| Ampicillin | 1,47 mg/ml | Prostaglandin F2 | a0,033 mg/ml |
| Erythromycin | 0,272 mg/ml | Prostaglandin E2 | 0,033 mg/ml |
| Mütterlicher Urin 3. Trimester | 5 % (Vol.) | MonistatR (Miconazol) | 0,5 mg/ml |
| Oxytocin | 10 IE/ml | Indigo Karmin | 0,232 mg/ml |
| Terbutalin | 3,59 mg/ml | Gentamicin | 0,849 mg/ml |
| Dexamethason | 2,50 mg/ml | Betadine® Gel | 10 mg/ml |
| MgSO4•7H2O | 1,49 mg/ml | BetadineR Reiniger | 10 mg/ml |
| Ritodrin | 0,33 mg/ml | K-YR-Gelee | 62,5 mg/ml |
| Dermicidol® 2000 | 25,73 mg/ml |
LITERATUR REFERENZEN
1. Amerikanisches College für Geburtshelfer und Gynäkologen.Vorzeitige Wehen.Technical Bulletin, Nummer 133, Oktober 1989.
2. Creasy RK, Resnick R. Maternale und fötale Medizin: Prinzipien und Praxis.Philadelphia: WB Saunders;1989.
3. Creasy RK, Merkatz IR.Prävention von Frühgeburten: klinische Meinung.Obstet Gynecol 1990;76(Ergänzung 1):2S–4S.
4. Morrison JC.Frühgeburt: ein Rätsel, das es wert ist, gelöst zu werden.Obstet Gynecol 1990;76(Ergänzung 1):5S-12S.
5. Lockwood CJ, Senyei AE, Dische MR, Casal DC, et al.Fetales Fibronectin in Zervix- und Vaginalsekret als Prädiktor für Frühgeburten.New Engl J Med 1991;325:669–74.
GLOSSAR DER SYMBOLE
|
| Katalognummer |  | Temperaturbegrenzung |
 | Gebrauchsanweisung konsultieren |
| Batch-Code |
 | In-vitro-Diagnostikum |  | Verwenden von |
 | Hersteller |  | Enthält ausreichend fürPrüfungen |
 | Nicht wiederverwenden |  | Bevollmächtigter Vertreter in der Europäischen Gemeinschaft |
 | CE-gekennzeichnet gemäß IVD-Medizinprodukte-Richtlinie 98/79/EG | ||
Liming Bio-Products Co., Ltd.
Nr. 12 Huayuan Road, Nanjing, Jiangsu, 210042 VR China.
Tel: (0086)25 85476723 Fax: (0086)25 85476387
Email:sales@limingbio.com
Website: www.limingbio.com
www.stddiagnostics.com
www.stidiagnostics.com
WellKang Ltd. (www.CE-marking.eu) Tel: +44(20)79934346
29 Harley St., London WIG 9QR, GB Fax: +44(20)76811874
StrongStep® Fetales Fibronektin-Schnelltestgerät

Frühgeburten, definiert vom American College of Obstetricians and Gynecologists als Geburten vor der 37. Schwangerschaftswoche, sind für den Großteil der nicht-chromosomalen perinatalen Morbidität und Mortalität verantwortlich.Zu den Symptomen einer drohenden Frühgeburt gehören Uteruskontraktionen, Veränderung des Scheidenausflusses, Blutungen aus der Scheide, Rückenschmerzen, Bauchbeschwerden, Beckendruck und Krämpfe.Zu den diagnostischen Modalitäten zur Erkennung einer drohenden Frühgeburt gehören die Überwachung der Uterusaktivität und die Durchführung einer digitalen Zervixuntersuchung, die eine Abschätzung der zervikalen Dimensionen ermöglicht.
StrongStep® Fetaler Fibronektin-Schnelltest ist ein visuell interpretierter immunochromatographischer Test, der für den qualitativen Nachweis von fötalem Fibronektin in Zervikovaginalsekreten mit den folgenden Eigenschaften bestimmt ist:
Benutzerfreundlich:einstufiges Verfahren im qualitativen Testen
Schnell:nur 10 Minuten während desselben Patientenbesuchs erforderlich
Gerätefrei:die quellenbegrenzenden Krankenhäuser oder klinischen Einrichtungen können diesen Test durchführen
Geliefert:Raumtemperatur (2℃-30℃)