Eine Welt ein Kampf
─ In der Zusammenarbeit zur Aufbau einer globalen Gemeinschaft gemeinsamer Schicksal
Der neuartige Coronavirus, der weltweit fegte, hat zu einer anhaltenden globalen Covid-19-Pandemie-Krise geführt. Der Roman Coronavirus hat keine Grenzen, kein Land wird aus diesem Kampf gegen Covid-19 verschont. Als Reaktion auf diese weltweite COVID-19-Pandemie leistet die Liming Bio-Products Corp Beiträge zur Unterstützung des Wohlbefindens unserer globalen Gemeinschaften.
Unsere Welt steht derzeit mit den beispiellosen Auswirkungen der neuartigen Coronavirus-Krankheit 2019 (Covid-19) -Pandemie. Bisher gibt es kein effizientes Medikament für die Behandlung dieser Krankheit. Viele diagnostische Tests wurden jedoch zur Erkennung von Covid-19 entwickelt. Diese Tests basieren auf molekularen oder serologischen Methoden, um die neuartigen coronavirusspezifischen Nukleinsäure oder Antikörperbiomarker nachzuweisen. Da Covid-19 einen Pandemiestatus erreicht hat, ist eine frühzeitige Diagnose der neuartigen Coronavirus-Infektion von entscheidender Bedeutung für die Beurteilung der Ausbreitung des Virus und der Eindämmung, aber ein perfekter Test für den universellen Gebrauch existiert noch nicht. Wir müssen wissen, welche Tests möglicherweise zum Screening, Diagnose und Überwachung der Covid-19-Infektion verwendet werden können und welche Grenzen ihre Grenzen sind. Es ist sehr wichtig, wie man diese wissenschaftlichen Instrumente besser nutzt und dazu beiträgt, die Entstehung dieser schnell ausbreitenden und schweren Krankheit zu identifizieren und zu kontrollieren.
Der Zweck der Erkennung des neuartigen Coronavirus besteht darin, festzustellen, ob eine Person mit einer COVID-19-Infektion oder eines asymptotischen Trägers, der das Virus schweigend verbreiten kann, wesentliche Informationen zur Leitung der Entscheidungsfindung für die klinische Behandlung liefern kann. Frühere Studien haben gezeigt, dass 70% der klinischen Entscheidungen von den Testergebnissen abhängen. Wenn verschiedene Nachweisverfahren verwendet werden, sind auch die Anforderungen der Nachweisreagenzien unterschiedlich.
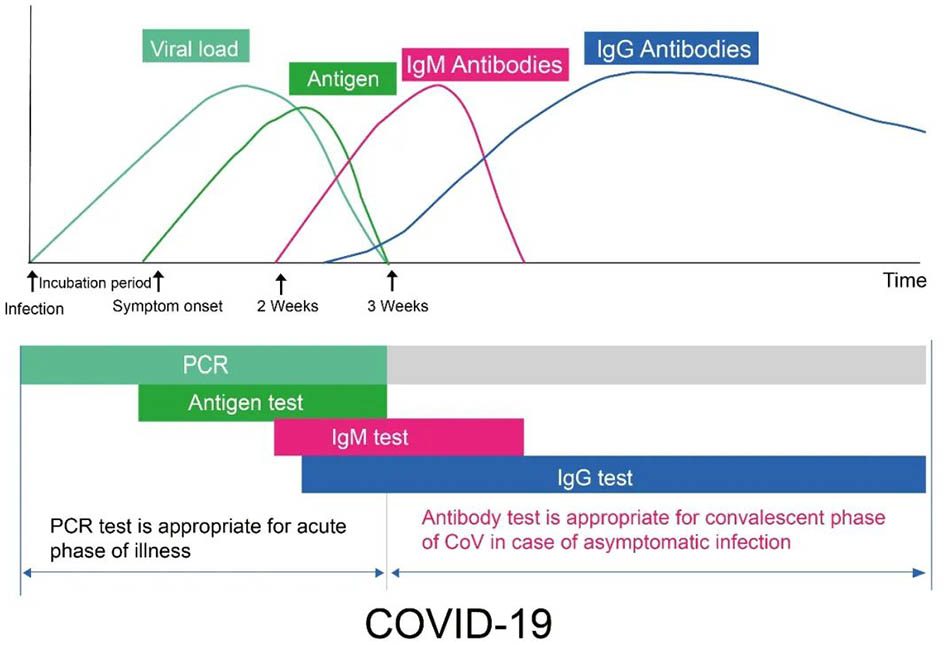
Abbildung 1
Abbildung 1:Diagramm, das die Schlüsselstadien der allgemeinen Biomarker-Werte während des typischen Zeitverlaufs der Covid-19-Infektion zeigt. Die x-Achse zeigt die Anzahl der Infektionstage an, und die y-Achse zeigt die Viruslast, die Konzentration von Antigenen und die Konzentration von Antikörpern in verschiedenen Zeiträumen an. Der Antikörper bezieht sich auf IgM- und IgG -Antikörper. Sowohl die RT-PCR- als auch die Antigen-Nachweis werden verwendet, um das Vorhandensein oder Fehlen neuer Coronavirus zu erkennen, was direkte Beweise für die Erkennung eines frühen Patienten darstellt. Innerhalb einer Woche der Virusinfektion, der PCR -Nachweis oder der Antigenerkennung wird bevorzugt. Nach der neuartigen Coronavirus -Infektion für etwa 7 Tage hat der IGM -Antikörper gegen das neue Coronavirus im Blut des Patienten allmählich zugenommen, aber die Dauer der Existenz ist kurz und ihre Konzentration nimmt schnell ab. Im Gegensatz dazu erscheint der IgG -Antikörper gegen das Virus später, normalerweise etwa 14 Tage nach der Virusinfektion. Die IgG -Konzentration nimmt allmählich zu und bleibt eine lange Zeit im Blut. Wenn der IGM im Blut des Patienten nachgewiesen wird, bedeutet dies, dass das Virus kürzlich infiziert ist, was ein früher Infektionsmarker ist. Wenn der IgG -Antikörper im Blut des Patienten nachgewiesen wird, bedeutet dies, dass die Virusinfektion seit einiger Zeit ist. Es wird auch als späte Infektion oder vorherige Infektion bezeichnet. Es ist oft bei Patienten in der Erholungsphase zu sehen.
Die Biomarker des neuartigen Coronavirus
Der neuartige Coronavirus ist ein RNA -Virus, das aus Proteinen und Nukleinsäuren besteht. Das Virus dringt in den Wirt (menschlicher) Körper ein, tritt durch die Bindungsstelle entsprechend Rezeptor ACE2 ein und repliziert in Wirtszellen, wodurch das menschliche Immunsystem auf fremde Invasoren reagiert und spezifische Antikörper produziert. Daher können die Fläschchen -Nukleinsäuren und Antigene sowie spezifische Antikörper gegen neuartige Coronavirus theoretisch als spezifische Biomarker zum Nachweis des neuartigen Coronavirus verwendet werden. Zum Nachweis der Nukleinsäure ist die RT-PCR-Technologie die am häufigsten verwendete, während serologische Methoden häufig zum Nachweis der neuartigen Coronavirus-spezifischen Antikörper verwendet werden. Derzeit stehen eine Vielzahl von Testmethoden zur Verfügung, die wir zum Testen der CoVID-19-Infektion auswählen können [1].
Grundprinzipien der Haupttestmethoden für neuartige Coronavirus
Viele diagnostische Tests für COVID_19 sind bisher verfügbar, wobei mehr Testkits täglich im Rahmen einer Notfallgenehmigung genehmigt werden. Obwohl die neuen Testentwicklungen so viele verschiedene Namen und Formate ergeben, beruhen alle aktuellen COVID_19-Tests grundsätzlich auf zwei Haupttechnologien: Nukleinsäuretektion für die virale RNA und serologische Immunoassays, die viralspezifische Antikörper nachweisen (IGM und IgG).
01. Nukleinsäurerkennung
Reverse Transcription-Polymerase-Kettenreaktion (RT-PCR), Loop-vermittelte isotherme Amplifikation (LAMP) und Sequenzierung der nächsten Generation (NGS) sind die üblichen Nukleinsäuremethoden zum Nachweis neuer Coronavirus-RNA. RT-PCR ist die erste Art von Test für CoVID-19, die sowohl von der Weltgesundheitsorganisation (WHO) als auch vom US-amerikanischen Zentrum für Krankheitskontrolle und Prävention (CDC) empfohlen wird.
02.Serologischer Antikörper -Nachweis
Der Antikörper ist ein schützendes Protein, das im menschlichen Körper als Reaktion auf die Virusinfektion produziert wird. Das IGM ist eine frühe Art von Antikörper, während IgG ein späterer Antikörper ist. Die Serum- oder Plasmaprobe wird normalerweise auf das Vorhandensein spezifischer IGM- und IgG-Arten des Antikörpers zur Bewertung von akuten und revaleszenden Phasen der Covid-19-Infektion untersucht. Diese nachweisungsbasierten Nachweismethoden umfassen kolloidale Gold-Immunochromatographie-Assays, Latex oder fluoreszierende Mikrosphären-Immunochromatographie, enzymgebundener Immunosorbent-Assay (ELISA) und Chemilumineszenz-Assay.
03.Virale Antigenerkennung
Antigen ist eine Struktur des Virus, die vom menschlichen Körper erkannt wird und das Immunabwehrsystem auslöst, um Antikörper zu produzieren, um das Virus aus Blut und Geweben zu entfernen. Ein auf dem Virus vorhandenes virales Antigen kann unter Verwendung von Immunoassay gezielt und nachgewiesen werden. Wie virale RNA sind auch virale Antigene im Atemweg infizierter Personen vorhanden und können zur Diagnose der Akutphase der CoVID-19-Infektion verwendet werden. Daher wird häufig empfohlen, obere Atemwaffenproben wie Speichel, Nasopharyngeal- und Oropharyngealströme, tiefen Hustensputum, bronchoalveolarer Lavageflüssigkeit (BALF) für anfängliche Antigen -Tests zu sammeln.
Auswahl von Testmethoden für neuartige Coronavirus
Die Auswahl einer Testmethode beinhaltet viele Faktoren, einschließlich klinischer Einstellung, Testqualitätskontrolle, Turnaround -Zeit, Testkosten, Probenahmeerfassungsmethoden, technische Anforderungen des Laborpersonals, Anforderungen an Einrichtungen und Geräte. Der Nachweis von Nukleinsäuren oder viralen Antigenen besteht darin, direkte Beweise für das Vorhandensein der Viren zu liefern und die Diagnose einer neuen Coronavirus -Infektion zu bestätigen. Obwohl es viele Methoden zur Antigenerkennung gibt, ist ihre Erkennungsempfindlichkeit des neuartigen Coronavirus theoretisch niedriger als die der RT-PCR-Amplifikation. Antikörpertests ist der Nachweis von Antivirenantikörpern, die im menschlichen Körper produziert werden und zeitlich zurückbleiben und häufig nicht zum frühen Nachweis während der akuten Phase der Virusinfektion verwendet werden. Die klinische Einstellung für Erkennungsanwendungen kann variieren und die Probenerfassungsstellen können ebenfalls unterschiedlich sein. Zum Nachweis von viralen Nukleinsäuren und -antigenen muss das Probe im Atemweg gesammelt werden, wo das Virus vorhanden ist, wie nasopharyngeale Abstriche, oropharyngeale Abstriche, Sputum oder Bronchoalveary -Lavageflüssigkeit (BALF). Für den Nachweis der Antikörperbasis muss Blutproben gesammelt und auf das Vorhandensein eines spezifischen Anti-Virus-Antikörpers (IgM/IgG) untersucht werden. Antikörper- und Nukleinsäuretestergebnisse können sich jedoch gegenseitig ergänzen. Wenn das Testenergebnis beispielsweise die Nukleinsäure-negativ, igM-negativ, aber igG-positiv ist, deuten diese Ergebnisse darauf hin, dass der Patient derzeit das Virus nicht trägt, sondern von der neuartigen Coronavirus-Infektion gewonnen wurde. [2]
Vor- und Nachteile neuartiger Coronavirus -Tests
In der Diagnose- und Behandlungsprotokoll für neuartige Coronavirus -Pneumonie (Versuch Version7) (veröffentlicht von National Health Commission & State Administration der traditionellen chinesischen Medizin am 3. März 2020) werden Nukleinsäuretests als Goldstandardmethode für die Diagnose des Romans verwendet Coronavirus -Infektion, während Antikörpertests auch als eine der Bestätigungsmethoden für die Diagnose angesehen werden.

Pathogene und serologische Befunde
(1) pathogene Befunde: Neue Coronavirus-Nukleinsäure können in Nasopharyngealströmen, Sputum, Sekretionen mit niedrigeren Atemwege, Blut, Kot und anderen Proben unter Verwendung von RT-PCRAND/oder NGS-Methoden nachgewiesen werden. Es ist genauer, wenn Proben aus der unteren Atemwege (Sputum- oder Lufttraktextraktion) erhalten werden. Die Exemplare sollten so schnell wie möglich nach der Sammlung zum Testen eingereicht werden.
(2) Serologische Befunde: NCP-Virusspezifisches IGM wird um 3-5 Tage nach Beginn nachweisbar; IgG erreicht eine Titration von mindestens 4-facher Anstieg während der Genesung im Vergleich zur akuten Phase.
Die Auswahl der Testmethoden hängt jedoch von geografischen Standorten, medizinischen Vorschriften und klinischen Umgebungen ab. In den USA erteilte die NIH Coronavirus Disease 2019 (CoVID-19) Behandlungsrichtlinien (Standort aktualisiert: 21. April 2020) und die FDA Richtlinien für diagnostische Tests für Coronavirus Disease-2019 während des Notfalls der öffentlichen Gesundheit (ausgegeben am 16. März 2020 ), in denen serologische Tests der IgM/IgG -Antikörper nur als Screening -Test ausgewählt wurden.
Nukleinsäuretektionsmethode
RT_PCR ist ein hochempfindlicher Nukleinsäuretest, der feststellen soll, ob die neuartige Coronavirus -RNA im Atemweg oder in anderen Proben vorhanden ist oder nicht. Ein positives PCR-Testgebnis bedeutet das Vorhandensein neuer Coronavirus-RNA in der Probe, um die Covid-19-Infektion zu bestätigen. Ein negatives PCR -Testergebnis bedeutet nicht, dass das Fehlen der Virusinfektion nicht durch schlechte Probenqualität oder Krankheitszeitpunkt in der gewonnenen Phase usw. beeinflusst werden kann. Obwohl RT-PCR ein hochempfindlicher Test ist, hat es mehrere Nachteile. RT-PCR-Tests können arbeitsintensiv und zeitaufwändig sein und entscheidend von der hohen Qualität der Probe abhängen. Dies kann eine Herausforderung sein, da die Menge an viraler RNA nicht nur stark zwischen verschiedenen Patienten variiert, sondern auch innerhalb desselben Patienten variieren kann, abhängig von den Zeitpunkten, in denen die Probe gesammelt wird, sowie in den Infektionsphasen oder des Einsetzens klinischer Symptome. Das Nachweis des neuen Coronavirus erfordert hochwertige Proben, die eine ausreichende Menge an intakter viraler RNA enthalten.
Der RT-PCR-Test kann für einige Patienten mit einer COVID-19-Infektion ein falsches negatives Ergebnis (falsch negativ) ergeben. Wie wir wissen, befinden sich die Hauptinfektionsstellen des Romans Coronavirus in der Lunge und im Unterattrakt wie Alveoli und Bronchi. Daher ist das Sputum -Probe aus einem tiefen Husten oder der bronchoalveolären Lavageflüssigkeit (BALF) als höchste Empfindlichkeit für den Virusnachweis an. In der klinischen Praxis werden jedoch häufig Proben aus dem oberen Atemweg unter Verwendung von Nasopharyngeal- oder Oropharyngealstrichen entnommen. Das Sammeln dieser Exemplare ist nicht nur für Patienten unangenehm, sondern erfordert auch speziell ausgebildetes Personal. Um die Probenahme weniger invasiv oder einfacher zu machen, können die Patienten in einigen Fällen einen oralen Tupfer erhalten und es ihnen ermöglichen, eine Probe aus der bukkalen Schleimhaut oder der Zungenstreuung zu nehmen. Ohne ausreichende virale RNA kann RT-qPCR ein falsch negatives Testergebnis zurückgeben. In der Provinz Hubei, China, wurde die RT-PCR-Empfindlichkeit bei der anfänglichen Erkennung nur etwa 30%bis 50%mit durchschnittlich 40%gemeldet. Die hohe Rate falsch-negatives wurde höchstwahrscheinlich durch unzureichende Stichproben verursacht.
Darüber hinaus erfordert der RT-PCR-Test ein stark ausgebildetes Personal, um komplexe RNA-Extraktionsschritte und PCR-Amplifikationsverfahren durchzuführen. Es erfordert auch ein höheres Maß an Schutz der Biossicherheit, einer speziellen Laboranlage und einem Echtzeit-PCR-Instrument. In China muss der RT-PCR-Test für die Erkennung von CoVID-19 in Laboratorien der BiOSeafety Level 2 (BSL-2) durchgeführt werden, wobei der Schutz der Biosicherheit 3 (BSL-3) Praxis der Biosafety (BSL-3) ist. Nach diesen Anforderungen konnte die Kapazität des CDC -Labors Chinas Wuhan von Anfang Januar bis Anfang Februar 2020 nur einige hundert Fälle pro Tag erkennen. Normalerweise wäre dies kein Problem beim Testen anderer Infektionskrankheiten. Im Umgang mit einer globalen Pandemie wie Covid-19 mit potenziell Millionen von Menschen, die getestet werden sollen, wird RT-PCR aufgrund der Anforderungen an spezielle Laboreinrichtungen oder technische Geräte zu einem kritischen Problem. Diese Nachteile können die RT-PCR einschränken, die als effizientes Werkzeug für das Screening verwendet werden soll, und können auch zu Verzögerungen bei den Berichten über Testergebnisse führen.
Serologische Antikörper -Nachweismethode
Mit dem Fortschritt des Krankheitsverlaufs, insbesondere im mittleren und späten Stadium, ist die Antikörper -Nachweisrate sehr hoch. Eine Studie im Wuhan Central South Hospital ergab, dass die Antikörper-Nachweisrate in der dritten Woche der Covid-19-Infektion mehr als 90% erreichen könnte. Auch der Antikörper ist das Produkt der menschlichen Immunantwort gegen den neuartigen Coronavirus. Der Antikörpertest bietet mehrere Vorteile gegenüber RT-PCR. Erstens testet der serologische Antikörper einfach und schnell. Antikörper-Lateralflusstests können verwendet werden, um ein Ergebnis in 15 Minuten zu liefern. Zweitens ist das vom serologische Test nachgewiesene Ziel der Antikörper, von dem bekannt ist, dass es viel stabiler ist als die virale RNA. Während der Sammlung, des Transports, der Lagerung und des Tests sind die Proben für Antikörpertests im Allgemeinen stabiler als die Proben für RT-PCR. Drittens gibt es, da der Antikörper im Blutkreislauf gleichmäßig verteilt ist, eine geringere Probenahmevariation im Vergleich zum Nukleinsäuretest. Das für den Antikörpertest erforderliche Probenvolumen ist relativ gering. Beispielsweise reicht 10 Mikroliter mit Finger-Prick-Blut für den Einsatz im lateralen Strömungstest mit Antikörpern aus.
Im Allgemeinen wird der Antikörper -Test als Ergänzungsinstrument für den Nukleinsäuretektion ausgewählt, um die Nachweisrate des neuen Coronavirus während der Krankheitskurse zu verbessern. Wenn der Antikörpertest zusammen mit einem Nukleinsäuretest verwendet wird, kann er die Assaygenauigkeit für die Diagnose von CoVID19 erhöhen, indem potenzielle falsch positive und falsch negative Ergebnisse reduziert werden. Das aktuelle Betriebshandbuch empfiehlt nicht, zwei Testarten separat als unabhängiges Erkennungsformat zu verwenden, sollte jedoch als kombiniertes Format verwendet werden. [2]
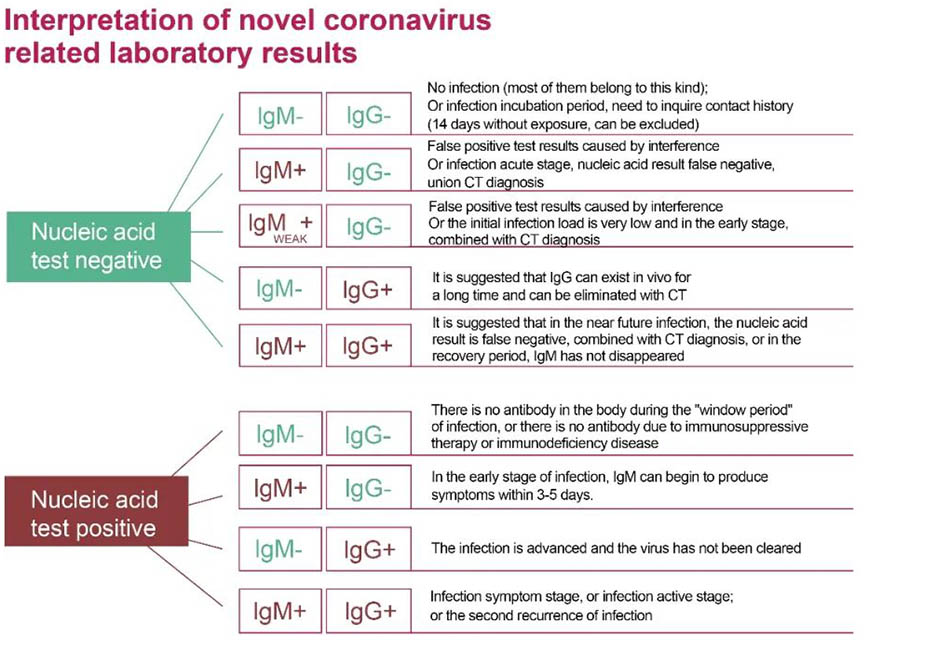
Abbildung 2:Die korrekte Interpretation von Nukleinsäure- und Antikörper -Testergebnissen zum Nachweis neuer Coronavirus -Infektionen

Abbildung 3:Liming Bio-Products Co., Ltd.-Neuartiger Coronavirus IgM/IgG-Antikörper Dual Rapid Test Kit (Strongstep®SARS-CoV-2 IgM/IgG-Antikörper-Schnelltest, Latex-Immunochromatographie)

Abbildung 4:Bio-Produkte Co., Ltd.-Strongstep®Neuartiger Coronavirus (SARS-CoV-2) Multiplex-Echtzeit-PCR-Kit (Nachweis für drei Gene, Fluoreszenzsondenmethode).
Notiz:Dieses hochempfindliche, einsatzbereite PCR-Kit ist im lyophilisierten Format (Freeze-Drogen-Prozess) für eine langfristige Speicherung erhältlich. Das Kit kann transportiert und bei Raumtemperatur gelagert werden und ist für ein Jahr stabil. Jedes Röhrchen der Vormischung enthält alle für die PCR-Amplifikation benötigten Reagenzien, einschließlich Reverse-Transkriptase, Taq-Polymerase, Primer, Sonden und DNTPS auf ein PCR -Instrument, um die Verstärkung durchzuführen.
Als Reaktion auf den neuartigen Coronavirus-Ausbruch hat Ltd. Siming Bio-Products Co., Ltd., schnell daran gearbeitet, zwei diagnostische Kits zu entwickeln, um klinische und öffentliche Gesundheitslabors zu ermöglichen, um eine COVID-19-Infektion schnell zu diagnostizieren. Diese Kits sind sehr geeignet für das großflächige Screening in Ländern und Regionen, in denen sich der neuartige Coronavirus-Ausbruch schnell ausbreitet, und für die Diagnose und Bestätigung für eine Infektion mit Covid-19. Diese Kits sind nur unter vorabverzählter Notfallverwalter (PEUA) verwendet. Die Tests beschränken sich auf Laboratorien, die gemäß den Vorschriften der nationalen oder lokalen Behörden zertifiziert sind.
Antigen -Erkennungsmethode
1. Die Nachweis des viralen Antigens wird in derselben Kategorie des direkten Nachweiss wie Nukleinsäurerkennung klassifiziert. Diese direkten Erkennungsmethoden suchen nach Hinweisen auf virale Krankheitserreger in der Probe und können zur Bestätigungsdiagnose verwendet werden. Die Entwicklung von Antigen -Nachweis -Kits erfordert jedoch eine hohe Qualität monoklonaler Antikörper mit starker Affinität und hoher Empfindlichkeit, die pathogene Viren erkennen und erfassen können. Die Auswahl und Optimierung eines monoklonalen Antikörpers, der für die Herstellung des Antigen -Nachweiskits geeignet ist, dauert normalerweise mehr als sechs Monate.
2. Derzeit stehen die Reagenzien zur direkten Erkennung des neuartigen Coronavirus noch im Forschungs- und Entwicklungsphadium. Daher wurde kein Antigen -Erkennungskit klinisch validiert und im Handel erhältlich. Obwohl zuvor berichtet wurde, dass ein diagnostisches Unternehmen in Shenzhen ein Antigen -Nachweis -Kit entwickelt und in Spanien klinisch getestet wurde, konnte die Assay -Zuverlässigkeit und -genauigkeit aufgrund des Vorhandenseins von Probleme der Reagenzienqualität nicht validiert werden. Bisher hat NMPA (frühere China FDA) noch kein Antigen -Nachweiskit für den klinischen Einsatz zugelassen. Zusammenfassend wurden verschiedene Erkennungsmethoden entwickelt. Jede Methode hat ihre Vorteile und Einschränkungen. Die Ergebnisse verschiedener Methoden können zur Überprüfung und Ergänzung verwendet werden.
3. Die Herstellung eines Qualitäts-COVID-19-Testkits hängt stark von der Optimierung während der Forschung und Entwicklung ab. Liming Bio-Product Co., Ltd. Testkits sind erforderlich, um strenge Standards für die Fertigungs- und Qualitätskontrollstandards zu erfüllen, um sicherzustellen, dass sie das höchste Leistungsniveau und Konsistenz bieten. Die Wissenschaftler von Liming Bio-Product Co., Ltd. verfügen über mehr als zwanzig Jahre Erfahrung beim Entwerfen, Testen und Optimieren von In-vitro-Diagnose-Kits, um das höchste Leistungsniveau bei der analytischen Quantifizierung zu gewährleisten.
Während der Covid-19-Pandemie stand die chinesische Regierung in den internationalen Hotspots in die enorme Nachfrage nach epidemischen Präventionsmaterialien. Am 5. April auf der Pressekonferenz des State Council Joint Prevention and Control Mechanismus "Stärkung des Qualitätsmanagements von medizinischen Material Aus dem Handel sagte: "Als nächstes werden wir unsere Bemühungen zunächst auf zwei Aspekte konzentrieren, um die Unterstützung von mehr medizinischen Versorgung zu beschleunigen, die von der internationalen Gemeinschaft benötigt werden, und um die Qualitätskontrolle, Regulierung und das Management der Produkte zu verbessern. Wir werden Chinas Beitrag dazu leisten, gemeinsam auf die globale Epidemie zu reagieren und eine Gemeinschaft mit einer gemeinsamen Zukunft für die Menschheit aufzubauen.



Abbildung 5:Ltd.'s neuartiges Coronavirus-Reagenz von Bio-Products Co., Ltd.
Die Ehrenzertifikat


Haushenshan
Abbildung 6. Liming Bio-Products Co., Ltd. unterstützte das Bergkrankenhaus von Wuhan Vulcan (Houshenshan), um gegen die Covid-19-Epidemie zu kämpfen, und erhielt die Ehrenzertifikat des Wuhan Roten Kreuzes. Das Wuhan Vulcan Mountain Hospital ist das berühmteste Krankenhaus in China, das sich auf die Behandlung schwerer Covid -19 -Patienten spezialisiert hat.
Während sich der neuartige Coronavirus-Ausbruch auf der ganzen Welt weiter ausbreitet, tritt Nanjing Liming Bio-Products Co., Ltd., um Gemeinschaften weltweit zu unterstützen und zu helfen, mit unseren innovativen Technologien zu bekämpfen, um diese beispiellose globale Bedrohung zu bekämpfen. Schnelle Tests einer Covid-19-Infektion sind ein wichtiger Bestandteil dieser Bedrohung. Wir tragen weiterhin auf erhebliche Weise bei, indem wir qualitativ hochwertige diagnostische Plattformen in die Hände der Angestellten an der Front liefern, damit die Menschen die kritischen Testergebnisse erhalten können, die sie benötigen. Die Bemühungen von Bio-Products Co., Ltd. im Kampf gegen Covid-19-Pandemie haben unsere Technologien, Erfahrungen und Fachkenntnisse in internationale Gemeinschaften zum Aufbau einer globalen Schicksalsgemeinschaft bei.
Langer Presse ~ Scan und folgen Sie uns
E-Mail: sales@limingbio.com
Website: https://limingbio.com
Postzeit: Mai-01-2020







